Die Neurobiologie der Sucht
Wer an einer Suchterkrankung leidet, dessen Gehirn hat sich verändert. Sein Belohnungssystem folgt nicht mehr dem evolutionär durchaus sinnvollen Zweck, sondern wurde zweckentfremdet: Es hat die Sucht gelernt.
Scientific support: Prof. Dr. Oliver von Bohlen und Halbach
Published: 08.09.2020
Difficulty: intermediate
- Sucht ist ein Lernprozess
- In mehreren Schritten gewöhnt sich das Gehirn immer stärker an das Suchtmittel
- Eine wichtige Rolle spielen Vernetzungen zwischen dem präfrontalen Cortex und dem dopaminergen, mesolimbischen System
- Die Hirnregionen beeinflussen sich dabei mittels so genannter Top-Down-Hemmung oder Bottom-Up-Prozessen
- Umkehren lassen sich diese Prozesse kaum
- Die Suchttherapie arbeitet mit Ansätzen, neue Dinge zu erlernen, die die vorhandenen Prozesse bei Suchtkranken in den Hintergrund treten lassen
Lernen, sich anstrengen, arbeiten – was uns antreibt, ist unser ständiges Verlangen nach Belohnung: Durch eine gute Note, ein höheres Gehalt oder mehr Anerkennung. Auslöser dafür ist unser Belohnungssystem. Entwickelt hat es sich, um uns zur Selbsterhaltung und zur Erhaltung der Art zu motivieren, indem wir Nahrung suchen und uns fortpflanzen. Doch uns moderne Menschen führt das Belohnungssystem auch dazu, dass wir von manchen Dingen gar nicht genug bekommen können.
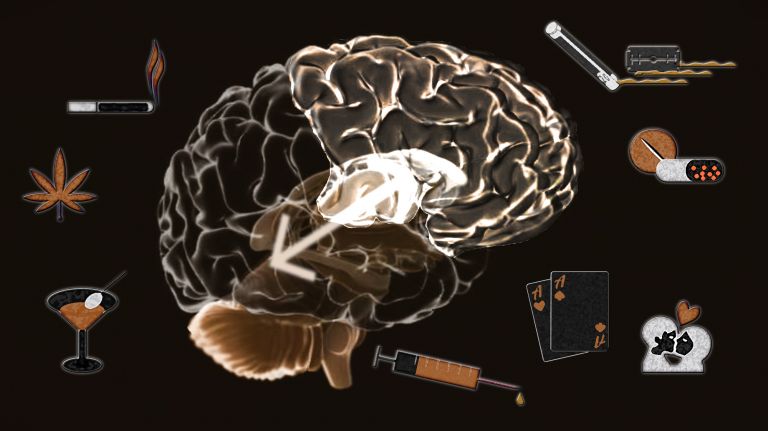
Besonders gefährlich wird es, wenn Menschen eine Art Abkürzung auf dem Weg zur neuronalen Belohnung nehmen: über Zigaretten, Alkohol oder eine Dosis Kokain – also jegliche Art von Drogen. Drogen wirken durch unterschiedliche Mechanismen und auf verschiedene Rezeptoren im Gehirn. Gemein ist aber allen, dass sie das Belohnungssystem mithilfe des Botenstoffs Dopamin aktivieren. Und das deutlich stärker, als alle natürlichen Belohnungen, die wir kennen. Amphetamine beispielsweise setzen bei Versuchstieren zehnmal mehr Dopamin frei als Nahrungsaufnahme oder Sex. Alkohol, Glücksspiel oder Cannabis kommen auf immerhin doppelt so viel.
Die Sucht als Lernprozess
Doch das Schlimme: Das Gehirn merkt sich, welche Stoffe zu einer besonderen Belohnung geführt haben. Das Verlangen nach den belohnenden Substanzen wird dadurch stärker, komplexe neuronale Anpassungsprozesse setzen ein und diese Adaptation verändert das Gehirn nachhaltig. Die enge Interaktion von Reizverarbeitung, Kognition, Gedächtnis und Emotion bedingen so ein Suchtverhalten, das nach und nach erlernt wird und schließlich in ein nahezu automatisiertes Handlungsmuster mündet.
Professor Falk Kiefer forscht an der Universität Heidelberg zur Neurobiologie der Sucht und leitet die Klinik für Abhängiges Verhalten und Suchtmedizin am Zentralinstitut für Seelische Gesundheit in Mannheim (ZI). Er vergleicht das Suchtverhalten gerne mit den Eigenschaften eines Klavierspielers, der ganz intuitiv auf ein vor ihm liegendes Notenblatt mit Empfindungen und Fingerbewegungen reagiert, ohne dies bewusst zu steuern. „Suchtverhalten kann auch nach langer Abstinenz abgerufen werden, so wie auch ein Klavierspieler trotz jahrelanger Pause nicht neu lernen muss, sondern an die gelernten Fähigkeiten anknüpft“, erklärt der Forscher.
Die Macht der Gewohnheit
Auf dem Weg zur Sucht sind mehrere Schritte besonders bedeutsam. Zunächst kommt es zu einer Gewöhnung an das durch die Substanzen ausgelöste Gefühl der Leichtigkeit und Euphorie. Diese Gewöhnung wird im Fachjargon als Habituation bezeichnet. Gleichzeitig wird der Suchtkranke immer sensibler für Reize, die mit der Aufnahme des Suchtstoffes in Verbindung stehen, zum Beispiel der Anblick eines Bierglases. Immer wird er an das schöne Gefühl bei Konsum der Droge erinnert und möchte dem Verlangen nach der Substanz nachgeben, was als Sensitivierung (Habit-Bildung) bezeichnet wird. Da gleichzeitig eine Toleranzentwicklung einsetzt, reicht dem Suchtkranken die letztmalige Dosis nicht mehr aus, um das gleiche Gefühl zu entwickeln – und er muss immer mehr konsumieren.
Neurowissenschaftlerin Sabine Vollstädt-Klein forscht am ZI an den Veränderungen im Gehirn, die bei diesem Prozess auftreten: Entscheidend für die Ausbildung einer Suchterkrankung ist das Zusammenspiel von Netzwerken des präfrontalen Cortex mit denen des dopaminergen mesolimbischen Systems. „Mesolimbisch“ beschreibt dabei die Position der Protagonisten des Belohnungssystems: Im Mittelhirn, dem Mesencephalon, findet sich das ventrale tegmentale Areal (VTA), dessen Neurone ihre dopaminerge Botschaft über lange Faserzüge an andere Regionen des Gehirns senden. Allen voran den Nucleus accumbens, der von seiner Funktion her oft zum limbischen System gezählt wird, das viele wichtige Strukturen umfasst, die bei Gedächtnisprozessen und Emotionen eine tragende Rolle spielen. Manche Anatomen sehen auch Teile des präfrontalen Cortex als zum limbischen System gehörig – und auch dort finden sich direkte Eingänge aus dem ventralen Tegmentum.
Tegmentum
Tegmentum/-/tegmentum
Tegmentum (von lateinischen „tegere“ „bedecken“). Es handelt sich um den rückwärtigen, unter dem Aquädukt gelegenen Teil des Mittelhirns. Hier finden sich Kerne wie die Substantia nigra, Formatio reticularis, Hirnnervenkerne und der Nucleus ruber.
Recommended articles
Abnehmende kognitive Kontrolle
Während diese Teile des präfrontalen Cortex dafür verantwortlich sind, dass wir in unterschiedlichen Situationen zielgerichtet handeln können, entstehen unsere Emotionen, insbesondere Freude, vor allem im mesolimbischen System. Auch das Belohnungssystem ist hier lokalisiert. Der präfrontale Cortex interagiert intensiv mit diesen Netzwerken.
„Bei Personen, die zu Abhängigkeit neigen, kann der präfrontale Cortex von vornherein eine Dysfunktion aufweisen“, erklärt Sabine Vollstädt-Klein. „Durch den anhaltenden Substanzkonsum wird dies noch verstärkt. Die kognitive Kontrolle nimmt dann ab!“
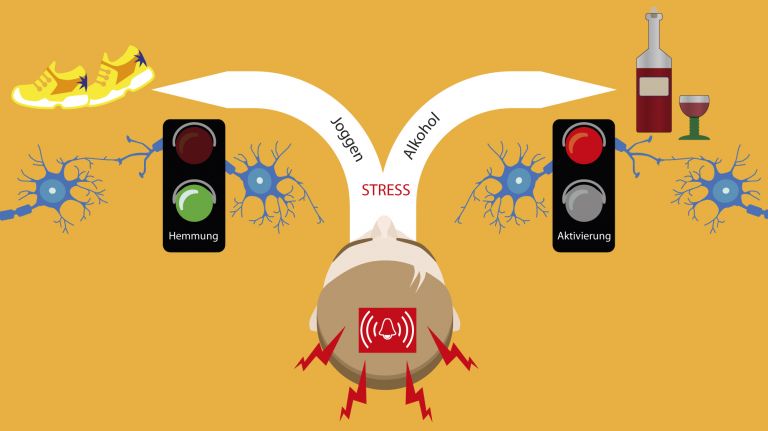
Diese kognitive Kontrolle über impulsives Verhalten und Automatismen wird auch als Top-Down-Hemmung bezeichnet. Umgekehrt sprechen die Wissenschaftler von Bottom-Up-Prozessen, wenn Reize wahrgenommen werden, in tieferen Hirnregionen verarbeitet und dann an höhere Hirnregionen wie den präfrontalen Cortex weitergeleitet werden.
„Bei Suchtpatienten kann das mesolimbische System durch diese Bottom-Up-Prozesse den präfrontalen Cortex sozusagen ‚kidnappen‘“, sagt Sabine Vollstädt-Klein. Reflexe, Gewohnheiten und drängendes Verlangen nehmen dann überhand.
Der Sucht auf die Finger geschaut
Durch bildgebende Verfahren wie die funktionelle Magnetresonanztomografie (MRT) konnten in den letzten Jahren die neurobiologischen Adaptationsmechanismen im Rahmen von Abhängigkeitserkrankungen immer genauer verstanden werden. Ein besonders bedeutendes Kerngebiet im mesolimbischen System ist dabei das so genannte Striatum. Es wird in einen ventralen (nach vorne gerichteten) Teil und einen dorsalen (zum Rücken gerichteten) Teil unterschieden. Im ventralen Striatum ist auch der Nucleus accumbens lokalisiert, der als das „Lustzentrum“ im Gehirn gilt.
„In bildgebenden Studien lässt sich beobachten, dass bei zunehmender Abhängigkeit die Aktivierung vom ventralen Striatum in das dorsale Striatum wandert“, erklärt Sabine Vollstädt-Klein. Dieser Shift von ventral nach dorsal könnte damit im Zusammenhang stehen, dass sich auch das Verhalten von Suchtkranken in Bezug auf Drogen im Verlauf ändert. Während die Abhängigen anfangs noch freiwillig und zum Vergnügen konsumieren, verlieren sie zunehmend die Kontrolle über ihr Verhalten und sehen sich immer stärker gezwungen, Drogen zu nehmen.
Umkehren lassen sich diese Mechanismen kaum. „Das Gehirn hat keine Löschfunktion“, gibt Falk Kiefer zu Bedenken. „Aber man kann neue Dinge lernen, die im Alltag nach und nach mehr Platz einnehmen und das vorher Gelernte in den Hintergrund rücken lassen.“ Zusammen mit seiner Kollegin Sabine Vollstädt-Klein forscht er an Ansätzen, wie das in der Suchttherapie immer besser gelingen könnte. Anfangs müsse das Erlernen neuer Verhaltensweisen allerdings sehr bewusst erfolgen, später werde es dann mehr und mehr selbstverständlich. „Doch auch nach längerer Abstinenzzeit wird es immer wieder Situationen geben, die das Suchtverhalten reaktivieren können“, erklärt Falk Kiefer. „Abstinenz ist, so gesehen, ein Prozess, in dem immer wieder aufs Neue eine bewusste Entscheidung für die Abstinenz getroffen werden muss – weil eben nichts ganz verlernt oder gar gelöscht ist.“
Zum Weiterlesen:
- Vollstädt-Klein et al., „Initial, habitual and compulsive alcohol use is characterized by a shift of cue processing from ventral to dorsal striatum“, Addiction 2010
- Everitt et al., „Drug Addiction: Updating Actions to Habits to Compulsions Ten Years On“, Annu. Rev. Psychol. 2016